cho 12.1gam hỗn hợp với 2 kim loại Zn và Fe có số mol bằng nhau vào dung dịch chứa 0,5mol HCl các phản ứng hoá học xảy ra theo sơ đồ : Zn+HCL-> ZnCl2+H2 Fe+HCl-> FeCl2+H2 a) Hỏi su phản ứng chất nào còn dư? Dư bao nhiêu gam? b)Tính khối lượng mỗi muối thu được Câu 2: Hoà tan hòn toàn 5,4g hỗn hợp bột A gồm Mg , Fe trong dung dịch HCl dư, tạo thành 3,36 lít (đktc) a)Viết các PTHH xảy ra b)Tính khối lượn muối tạo thành c)Tính khối lượng mỗi kim loại trong hỗn hợp A
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Zn +2 HCl ---> ZnCl2 + H2
0,1-----0,2----------0,1-------------0,1 mol
ZnO + 2HCl ---> ZnCl2 + H2O
0,2------0,4-------0,2--------0,2
n H2=\(\dfrac{2,24}{22,4}=0,1mol\)
=>m Zn=0,1.65=6,5g
=>m HCl(1)=0,2.36,5=7,3g
=>m HCl(2)=14,6g -> nHCl=0,4 mol
=>%m Zn=\(\dfrac{6,5}{6,5+14,4}.100=31,1\%\)
=>%m ZnO=68,9%
b)
->m HCl=0,6.36,5=21,9g
->m ZnCl2=0,3.136=40,8g

Chọn B
Tính nhanh được nN2O = 0,03 mol và nH2 = 0,025 mol; nFe = 0,09 mol
Do khi cho dung dịch AgNO3 dư vào B thấy có khí NO thoát ra nên B có chứa HCl dư
nHCl dư = nH+ dư = 4nNO = 0,06 mol (do 3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O)
=> nHCl pu với A = 0,69 – 0,06 = 0,63 mol
Ta có: A + HCl → muối + khí + H2O
BTKL => mH2O = mA + mHCl pư với A – m muối – m khí = 26,27 + 0,63.36,5 – 0,03.44 – 0,025.2 = 4,5 (g)
=> nH2O = 0,25 mol
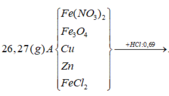
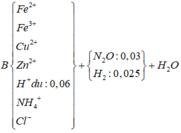
BT “H”: nNH4+ = (nHCl – nH+ dư - 2nH2 – 2nH2O):4 = (0,69-0,06-2.0,025-2.0,25):4 = 0,02 mol
BT “N”: nFe(NO3)2 = (2nN2O + nNH4+):2 = (2.0,03 + 0,02):2 = 0,04 mol
BT “O”: 6nFe(NO3)2 + 4nFe3O4 = nN2O + nH2O => 6.0,04+4nFe3O4 = 0,03+0,25 => nFe3O4 = 0,01 mol
BT “Fe”: nFe = nFe(NO3)2 + 3nFe3O4 + nFeCl2 => 0,09 = 0,04 + 3.0,01 + nFeCl2 => nFeCl2 = 0,02 mol
Khi cho B + AgNO3 dư
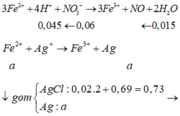
![]()
![]()
![]()
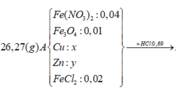
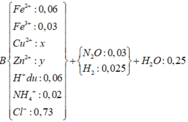
![]()
![]()
![]()
![]()
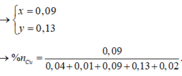
![]()

Đáp án B
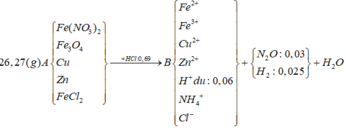
Tính nhanh được nN2O = 0,03 mol và nH2 = 0,025 mol; nFe = 0,09 mol
Do khi cho dung dịch AgNO3 dư vào B thấy có khí NO thoát ra nên B có chứa HCl dư
nHCl dư = nH+ dư = 4nNO = 0,06 mol (do 3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O)
=> nHCl pu với A = 0,69 – 0,06 = 0,63 mol
Ta có: A + HCl → muối + khí + H2O
BTKL => mH2O = mA + mHCl pư với A – m muối – m khí = 26,27 + 0,63.36,5 – 0,03.44 – 0,025.2 = 4,5 (g)
=> nH2O = 0,25 mol
BT “H”: nNH4+ = (nHCl – nH+ dư - 2nH2 – 2nH2O):4 = (0,69-0,06-2.0,025-2.0,25):4 = 0,02 mol
BT “N”: nFe(NO3)2 = (2nN2O + nNH4+):2 = (2.0,03 + 0,02):2 = 0,04 mol
BT “O”: 6nFe(NO3)2 + 4nFe3O4 = nN2O + nH2O => 6.0,04+4nFe3O4 = 0,03+0,25 => nFe3O4 = 0,01 mol
BT “Fe”: nFe = nFe(NO3)2 + 3nFe3O4 + nFeCl2 => 0,09 = 0,04 + 3.0,01 + nFeCl2 => nFeCl2 = 0,02 mol
Khi cho B + AgNO3 dư:


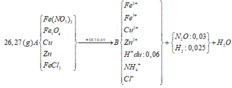
Tính nhanh được nN2O = 0,03 mol và nH2 = 0,025 mol; nFe = 0,09 mol
Do khi cho dung dịch AgNO3 dư vào B thấy có khí NO thoát ra nên B có chứa HCl dư
nHCl dư = nH+ dư = 4nNO = 0,06 mol (do 3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O)
=> nHCl pu với A = 0,69 – 0,06 = 0,63 mol
Ta có: A + HCl → muối + khí + H2O
BTKL => mH2O = mA + mHCl pư với A – m muối – m khí = 26,27 + 0,63.36,5 – 0,03.44 – 0,025.2 = 4,5 (g)
=> nH2O = 0,25 mol
BT “H”: nNH4+ = (nHCl – nH+ dư - 2nH2 – 2nH2O):4 = (0,69-0,06-2.0,025-2.0,25):4 = 0,02 mol
BT “N”: nFe(NO3)2 = (2nN2O + nNH4+):2 = (2.0,03 + 0,02):2 = 0,04 mol
BT “O”: 6nFe(NO3)2 + 4nFe3O4 = nN2O + nH2O => 6.0,04+4nFe3O4 = 0,03+0,25 => nFe3O4 = 0,01 mol
BT “Fe”: nFe = nFe(NO3)2 + 3nFe3O4 + nFeCl2 => 0,09 = 0,04 + 3.0,01 + nFeCl2 => nFeCl2 = 0,02 mol
Khi cho B + AgNO3 dư:
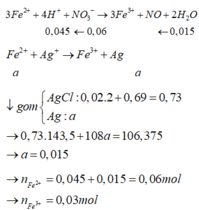

Đáp án B

PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\) (1)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\) (2)
Ta có: \(\Sigma n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Gọi số mol của ZnCl2 là \(a\) \(\Rightarrow n_{H_2\left(1\right)}=a\)
Gọi số mol của FeCl2 là b \(\Rightarrow n_{H_2\left(2\right)}=b\)
Ta lập được hệ phương trình:
\(\left\{{}\begin{matrix}a+b=0,2\\136a+127b=26,3\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\Sigma n_{HCl}=0,4mol\) \(\Rightarrow m_{HCl}=0,4\cdot36,5=14,6\left(g\right)\)

a, \(Fe+2HCl\rightarrow FeCl_2+H_2\)
b, Ta có: \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Theo PT: \(n_{FeCl_2}=n_{H_2}=n_{Fe}=0,1\left(mol\right)\)
\(\Rightarrow m_{FeCl_2}=0,1.127=12,7\left(g\right)\)
\(V_{H_2}=0,1.22,4=2,24\left(l\right)\)

a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Theo PT: \(n_{HCl}=2n_{Zn}=0,4\left(mol\right)\Rightarrow C_{M_{HCl}}=\dfrac{0,4}{0,2}=2\left(M\right)\)
b, Theo PT: \(n_{H_2}=n_{Zn}=0,2\left(mol\right)\)
\(n_{O_2}=\dfrac{0,224}{22,4}=0,01\left(mol\right)\)
PT: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,01}{1}\), ta được H2 dư.
Theo PT: \(n_{H_2\left(pư\right)}=2n_{O_2}=0,02\left(mol\right)\)
\(\Rightarrow n_{H_2\left(dư\right)}=0,18\left(mol\right)\Rightarrow V_{H_2\left(dư\right)}=0,18.22,4=4,032\left(l\right)\)
A) Ta sử dụng phương trình cân bằ để tính số mol của Zn:
Zn + 2HCI -> ZnCl2 + H2
Theo đó, số mol Zn = số mol HCI C
dùng
Mặt khác, theo đề bài, ta biết số ga
Zn là 13g. Từ khối lượng và khối
lượng riêng của Zn, ta tính được s
mol Zn:
n(Zn) = m(Zn) / M(Zn) = 13/65.38
0.199 mol
Vậy số mol HCl đã dùng cũng bằn
0.199 mol.
Nồng độ mol của dung dịch HCl đã dùng:
C(HCI)= n(HCI) / V(HCI) = 0.199 / 0.2
= 0.995 M
Theo phương trình phản ứng, 1 mol Zn sinh ra 1 mol H2. Vậy số mol H2 sinh ra trong phản ứng là 0.199 mol.
Theo định luật Avogadro, 1 mol khí ở điều kiện tiêu chuẩn (ĐKTC) chiếm thể tích là 22.4 lít. Vậy thể tích của 0.199 mol H2 ở ĐKTC là:
V(H2) = n(H2) x 22.4 = 0.199 x 22.4 = 4.45 lít
Do đó, khí O2 đã phản ứng với H2 để tạo ra nước. Theo phương trình phản ứng, ta biết tỉ lệ mol giữa O2 và H2 là 1:2. Vậy số mol O2 đã phản ứng là 0.199/20.0995 mol.
Từ đó, ta tính được khối lượng của O2 đã phản ứng:
m(O2) = n(O2) x M(O2) = 0.0995 x 32
Vậy chất còn dư sau phản ứng là O2, thể tích của O2 còn dư là:
V(O2) = m(02) x (1/V(Mol)) x (V(DKTC)/P) = 3.184 x (1/32) x (273/1) / (1.01 x 10^5) = 0.083 lít (lít ở ĐKTC)

Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Zn}=2a\left(mol\right)\\n_{Fe}=3a\left(mol\right)\end{matrix}\right.\)
Ta có: \(m_{t\text{ăng}}=m_{KL}-m_{H_2}\)
\(\Rightarrow m-m_{H_2}=m-2,4\\ \Leftrightarrow m_{H_2}=2,4\left(g\right)\Rightarrow n_{H_2}=\dfrac{2,4}{2}=1,2\left(mol\right)\)
PTHH:
`Mg + 2HCl -> MgCl_2 + H_2`
`Zn + 2HCl -> ZnCl_2 + H_2`
`Fe + 2HCl -> FeCl_2 + H_2`
Theo PTHH:
\(n_{H_2}=n_{Mg}+n_{Zn}+n_{Fe}=a+2a+3a=6a\left(mol\right)\\ \Rightarrow6a=1,2\Leftrightarrow a=0,2\left(mol\right)\\ \Rightarrow\left\{{}\begin{matrix}n_{Mg}=0,2\left(mol\right)\\n_{Zn}=0,2.2=0,4\left(mol\right)\\n_{Fe}=0,2.3=0,6\left(mol\right)\end{matrix}\right.\)
Vậy \(m=0,2.24+0,4.65+0,6.56=64,4\left(g\right)\)


